卫材株式会社(Eisai Co., Ltd.)正在中国开展一项评价 乐伐替尼(Lenvatinib,2017年5月后被正式更名为“仑伐替尼”)安全性和有效性的III期临床研究 ,现已进入结束倒计时阶段,目标人群为I131难治性、分化型甲状腺癌(DTC)患者。该研究已获得CFDA批准(登记号:CTR20160121),且已通过各研究中心伦理委员会审批。
医脉通邀请您参与项目,为试验介绍患者!可通过文末 推荐二维码 直接推荐,或直接和我们联系。推荐患者,即可得医脉通双重奖励。如有疑问,也请随时联系我们。
研究概要
研究课题:乐伐替尼(E7080)用于中国放射性碘131难治性分化型甲状腺癌患者的一项多中心、随机、双盲、安慰剂对照试验
研究目的:比较患有放射性I131难治性分化型甲状腺癌(DTC)并且在前12个月内有疾病进展的影像学证据的患者在接受乐伐替尼与安慰剂治疗后的无进展生存期(PFS)。
申办方:卫材株式会社(Eisai Co., Ltd.)
试验药物:E7080胶囊(乐伐替尼)
受试者:I131难治性、分化型的甲状腺癌患者
药物介绍
乐伐替尼是一种独特的多靶点受体酪氨酸激酶抑制剂(VEGF受体-1,2,3; FGF受体-1, 2, 3, 4; PDGFRα; RET 和KIT)。自2015年起,已被美国、欧洲、日本相继等多个国家和地区批准用于I131难治的甲状腺癌。
药物特点如下:
l 多靶点TKIs,既往应用过1种靶向药物的甲状腺癌患者也可尝试应用;
l 国外的临床研究数据表明,乐伐替尼能显著延长难治甲状腺癌患者的PFS;
l 在肝癌领域取得继索拉非尼后,20年来唯一突破性进展;
l 首个获取CFDA优先评审资格的靶向药物。
患者受益与安全
l ➤患者参与研究期间,试验要求的相关检查和试验药品免费;
l ➤患者按照试验要求来医院随访,每次随访交通补贴150元;
l ➤医生对受试者可能面临的风险进行监控,如果出现损害时会及时给予治疗;会尊重患者意愿,允许患者随时退出试验;
l ➤经验丰富的临床医师进行用药观察和随访指导;
l ➤申办方为整个研究购买临床试验保险;
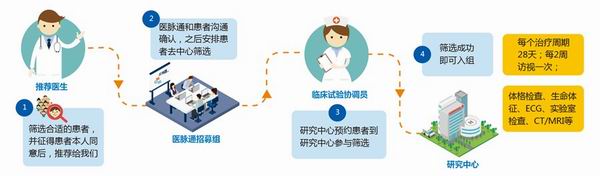
参与流程
主要入选标准
1. 受试者必须有经组织学或细胞学确诊的下列某种 DTC 亚型:乳头状甲状腺癌(PTC)、滤泡状甲状腺癌(FTC)。
2. 受试者病变经中心影像学审核确证是可测量的。
3. 根据 RECIST 1.1,通过中心放射学检查(CT和/或MRI扫描)评估和确证,比较筛选期扫描和签署知情同意书之前12个月内的既往历史扫描,必须有证据表明受试者出现疾病进展。
4. 受试者必须不具有通过手术治愈的可能性,且符合I131难治性/抵抗性癌症的诊断标准。
a. 经所有放射性碘扫描均显示不存在碘摄入的一个或多个可测量病变。
b. 根据 RECIST 1.1,一个或多个可测量病变在I131治疗 12 个月内出现进展,尽管治疗前或治疗后影像学显示出放射性碘亲和力。
c. 入组前末次给药距离研究入组至少 6 个月,接受的I131累积活性>600 mCi 或22 GBq,。
5. 受试者未接受过或已接受过 1 种既往 VEGF/VEGFR-靶向治疗(例如,索拉非尼、舒尼替尼、帕唑帕尼等)。
6. 病情仍然稳定、无症状且停用甾类药物至少1个月的脑转移患者,符合参与研究的要求。
7. 受试者正在接受甲状腺素抑制治疗,并且促甲状腺素(TSH)应≤0.1 mU/L(如果出于安全性考虑应≤0.5 mU/L)。
8. 其他一般状况良好:体力状况评分、肝肾功能、骨髓功能、凝血功能等。

联系我们
座机:010-52596078转 203、202、201
手机:17190442160(可加微信,随时和我们沟通)